Spis treści
Białka, bo to o nich będzie mowa, zasadniczo różnią się od opisanych już przeze mnie węglowodanów, które są pasywnym rezerwuarem energii. Białka natomiast są elementem składowym organizmu – tworzą nas, poczynając od fundamentalnych elementów jakim są komórki. Jak są zbudowane białka? Jakie aminokwasy wyróżniamy? Czym się różnią między sobą? Czy mają smak? Czym się różni denaturacja od koagulacji białek? Co to są enzymy i jaka jest ich rola? Czy i jak można zepsuć galaretkę?

Źródło: Spiske, M. https://unsplash.com/photos/A1Yob9kBmKk (dostęp 07.12.2020r.).
Budowa białek
Białka są polimerami, czyli substancjami chemicznymi, które składają się z wielokrotnie powtórzonych jednostek. Tymi podstawowymi elementami są aminokwasy. Każdy z nich składa się z węgla, wodoru i tlenu oraz najważniejszego, czyli grupy aminowej NH2 (stąd nazwa aminokwas). W sumie jest od 10 do 40 atomów w jednej cząsteczce. Aminokwasy łączą się ze sobą różnymi wiązaniami tworząc peptydy lub białka, gdy takich „bloczków” jest wystarczająco dużo.

Przykłady aminokwasów i ich podział w oparciu o właściwości chemiczne.
Źródło: Aminokwasy, peptydy, białka – charakterystyka.
https://www.naukowiec.org/wiedza/chemia/aminokwasy-peptydy-bialka_3416.html (dostęp 02.12.2020r.).
Jak możesz zauważyć, aminokwasy różnią się między sobą w budowie. To przekłada się na ich właściwości, a także na reakcje, w które wchodzą z innymi cząsteczkami. Jedne będą chętnie łączyć się z wodą poprzez wiązania wodorowe. Ponieważ nie stronią od niej, należą do grupy polarnych/hydrofilowych. Z kolei niepolarne/hydrofobowe „nie lubią” się z wodą i nie będą skłonne tworzyć z nią powiązań. Niektóre aminokwasy przypominają swą budową tłuszcze i będą wytwarzać słabe wiązania van der Waalsa z innymi molekułami. Zauważ, że niektóre z aminokwasów mają w swej cząsteczce atom siarki (S), jak choćby metionina czy cysteina. Pierwiastek ten jest bardzo reaktywny, zatem chętnie będzie wchodził w reakcję z innymi poprzez silne wiązania kowalencyjne. Jak widzisz, te cechy strukturalne mają ogromny wpływ na właściwości aminokwasów.
Ciekawe jest to, że każdy z aminokwasów wywołuje określone wrażenia smakowe. Możemy je spotkać np. w długodojrzewających serach, podsuszanych kiełbasach i szynkach (np. salami, prosiutto, chorizo) czy sosie sojowym. Są to produkty, których produkcja jest czasochłonna, a właściwie samo dojrzewanie i fermentacja. Podczas tych procesów białka i peptydy rozpadają się z powrotem na aminokwasy, a te zapewniają odpowiednie odczucia smaku, a mianowicie:
Smak gorzki:
- Arginina
- Histydyna
- Izoleucyna
- Leucyna
- Lizyna
- Metionina
- Fenyloalanina
- Walina
- Tyrozyna
Smak słodki:
- Alanina
- Glicyna
- Prolina
- Seryna
- Treonina
- Asparagina
- Glutamina
Smak umami:
- Kwas glutaminowy
- Kwas asparaginowy
Denauracja białek
Cząsteczki, z których składają się białka, połączone są wiązaniami, w ten sposób tworząc ich strukturę. Jednak nie jest ona permanentna i może ulec zmianie. To jest właśnie denaturacja. Wiązania ulegają zniszczeniu i tym samym dochodzi do transformacji struktury, ale sam skład białka pozostaje bez zmian. Jednak to struktura determinuje właściwości, zatem zdenaturowane białko będzie zachowywało się zupełnie inaczej. Początkowo pozwijane lub poskręcane łańcuchy aminokwasów rozwijają się i prostują. Pomyśl sobie o surowym i ugotowanym czy usmażonym jajku.
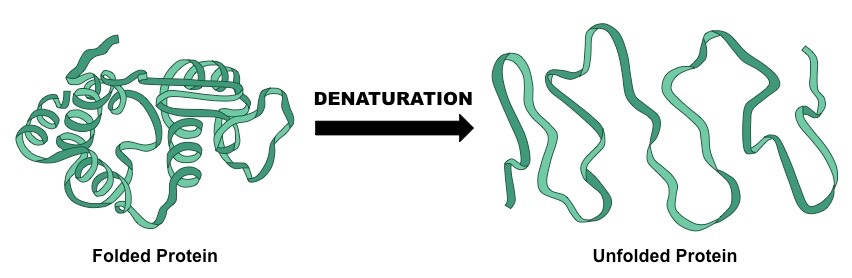
Denaturacja białek (‘folded protein’ – białko niezdenaturowane, ‘unfolded protein’ – białko zdenaturowane).
Źródło: https://ib.bioninja.com.au/standard-level/topic-2-molecular-biology/24-proteins/denaturation.html (dostęp 07.12.2020r.).
A jak dochodzi do denaturacji? Kiedy zachodzą zmiany w wiązaniach? Sposobów jest kilka, a najprostszym i pewnie najczęściej stosowanym jest temperatura. Ekspozycja białek w 60-80°C powoduje zmiany w strukturze. Każde białko ma inną wrażliwość na temperaturę, dlatego też jedno będzie przechodzić transformację już przy niższej wartości, a inne z kolei będzie potrzebowało więcej energii cieplnej do tych zmian.

Źródło: Gurrola, G. https://unsplash.com/photos/CxSIQqRnrns (dostęp 07.12.2020r.).
Inną metodą jest zastosowanie kwasu. W środowisku kwasowym, przy niskim pH, będą również zachodzić zmiany strukturalne. W tym przypadku tak samo białka wykazują różną wrażliwość. Pęcherzyki powietrza także mogą prowadzić do denaturacji. Połączenie tych różnych czynników, czyli temperatury, kwasu, powietrza także skutkują zmianami strukturalnymi białek.
Wyjątkowy e-book z 20 przepisami na nietuzinkowe, autorskie dania: przystawki, zupy, dania główne i desery
Koagulacja białek
A czym się różni koagulacja od denaturacji? Jak już wiesz, w wyniku denaturacji łańcuchy białkowe zmieniają swoją strukturę: „rozkręcają się”, prostują. Są teraz bardziej „bezbronne” poprzez „odkrycie” bocznych grup. Są bardziej widoczne i dostępne, zatem mogą reagować z innymi tworząc z nimi wiązania. Na przykład są w stanie łapać cząsteczki wody. I na tym właśnie polega koagulacja. To proces, w którym tworzą się nowe wiązania między samymi łańcuchami białkowymi albo innymi cząsteczkami.
Przyjrzyjmy się kremowi angielskiemu. To po prostu mieszanka mleka, śmietanki, cukru, wanilii i żółtek, które odgrywają w nim najważniejszą rolę. Dlaczego? Bo to one odpowiadają za jego odpowiednio gęstą konsystencję. Przygotowanie tego kremu jest niezwykle proste – wystarczy podgrzewać miksturę. Trzeba być jednak bardzo uważnym i stale kontrolować temperaturę, ponieważ osiągnięcie zbyt wysokiej wartości temperatury spowoduje, że żółtka (a konkretnie obecne w nich białka) ulegną na tyle silnej denaturacji, że nie będzie już możliwości ich koagulacji. Albo będzie ona możliwa, jednak powstaną bardzo silne wiązania, które będą „wypychać” cząsteczki wody. W rezultacie otrzymamy „klupy” budyniu pływające w mlecznym płynie. Podobnie jest z mięsem czy rybą. Jeśli będą one poddane zbyt wysokiej temperaturze, mięso będzie przesuszone i twarde, a tym samym niesmaczne.

Zróżnicowana dieta pozwala dostarczyć niezbędne do prawidłowego funkcjonowania organizmu witaminy.
Źródło: Montes, P.M. https://unsplash.com/photos/0nT08Z-MhiE (dostęp 07.12.2020r.).
Enzymy
To również białka, które pełnią ważną funkcję. A mianowicie są katalizatorami reakcji chemicznych. W normalnych warunkach pewne procesy zachodzą bardzo wolno lub w ogóle, a enzymy przyspieszają te działania. Powodują zatem zmiany chemiczne. Każdy enzym jest specyficzny: katalizuje konkretną reakcję w odpowiednich warunkach tj. temperaturze i pH. Przekroczenie tych wartości może sprawić, że „stracą” one swą moc w wyniku denaturacji.
A gdzie te enzymy występują i jakie reakcje katalizują? Zacznijmy od podstaw, a mianowicie od trawienia. To enzymy rozkładają węglowodany na cukry proste, białka na aminokwasy czy tłuszcze na kwasy tłuszczowe i glicerol, które są następnie przyswajane przez nasz organizm. Są zatem niezbędne do trawienia pokarmów.

Rozkład węglowodanów (‘carbohydrates’), białek (‘proteins’) oraz tłuszczy (‘fats’) przez enzymy na glukozę (‘glucose’), aminokwasy (‘amino acids’) oraz kwasy tłuszczowe i glicerol (‘fatty acids & glycerol’).
Źródło: Digestive enzymes deficiency – Symptoms, Causes and 25 Natural Sources of Digestive Enzymes.
https://ecosh.com/digestive-enzymes-deficiency-symptoms-causes-and-25-natural-sources-of-digestive-enzymes/ (dostęp 07.12.2020r.).
Ale przejdźmy do żywności i jej obróbki jeszcze przed zjedzeniem. Zastanawiało Cię kiedyś, dlaczego jabłko, banan czy ziemniaki brązowieją zaraz po rozkrojeniu? Właśnie z powodu enzymów. To one (a konkretnie oksydaza polifenolowa) są odpowiedzialne za brązowienie owoców czy warzyw (utlenianie związków fenolowych do brązowej melaniny). Niektóre enzymy pomagają w zmiękczaniu mięsa (np. papaina, bromelaina).

Źródło: Why do apple slices turn brown after being cut?
https://www.scientificamerican.com/article/experts-why-cut-apples-turn-brown/ (dostęp 07.12.2020r.).
Na koniec jeszcze mała ciekawostka. Czy zdarzyło Ci się kiedyś, że nie stężała Ci galaretka, do której dodałeś świeżego ananasa? Nic dziwnego, ponieważ w tym owocu znajduje się wspomniana już bromelaina. To ona uniemożliwia ścięcie się galaretki, ponieważ enzym ten zakłóca pracę żelatyny (ona odpowiada za tężenie tego deseru) poprzez jej rozkład na mniejsze składowe. Jeśli jednak dodasz ananasa z puszki, wszystko pójdzie zgodnie z planem, ponieważ owoc ten był potraktowany na tyle wysoką temperaturą, że ananasowe enzymy zostały „unieszkodliwione”. Podobnie jest z kiwi.

Źródło: Nieścioruk, A. https://unsplash.com/photos/hw5kIbrdmBc (dostęp 07.12.2020r.).
Podsumowanie:
- Białka to polimery, których podstawowymi powtarzającymi się jednostkami są aminokwasy.
- Każdy aminokwas składa się z węgla, wodoru i tlenu oraz grupy aminowej.
- Denaturacja to proces, podczas którego wiązania ulegają zniszczeniu, a w rezultacie dochodzi do transformacji struktury. Sam skład białka pozostaje bez zmian.
- Koagulacja to proces, w którym tworzą się nowe wiązania między samymi łańcuchami białkowymi albo innymi cząsteczkami.
- Enzymy są katalizatorami reakcji chemicznych, czyli je przyspieszają.
Literatura:
McGee, H. (2007). On food and cooking: the science and lore of the kitchen. Simon and Schuster.
Arshad, M. S., Kwon, J. H., Imran, M., Sohaib, M., Aslam, A., Nawaz, I., … & Javed, M. (2016). Plant and bacterial proteases: A key towards improving meat tenderization, a mini review. Cogent Food & Agriculture, 2(1), 1261780.
Umami Basics. Pobrane z: https://www.umamiinfo.com/what/whatisumami/
Dlaczego owoce (banany, jabłka) brązowieją po skaleczeniu lub przekrojeniu? http://www.food-info.net/pl/qa/qa-fp138.htm



Cześć,
na wstępie zaznaczę, ze wyłapałem chyba jakiś brak w miejscu:
„(…) że nie będzie już możliwości ich . Albo będzie ona możliwa, jednak powstaną bardzo silne wiązania, które będą(…)”
wygląda jakby brakowało informacji po już możliwością ich … .
Jakbym mógł napisać sugestię, to może warto by jeszcze dodać informację jak przeciwdziałać brązowieniu owoców w praktyczny sposób? W źródłach jest informacja o tym, ale na zasadzie krótkiej notki odnośnie witaminy C (czyli chociażby polanie sokiem z cytryny bananów czy jabłek).
A tak poza tym jak dla mnie wszystko ponownie super i czekam na kolejne wpisy 🙂
Remek
Remku,
Dziękuję za uważną lekturę 😉 Cieszę się, że podobają Ci się publikowane treści.
Jeśli chodzi o brązowienie owoców, poświęcę temu procesowi (brązowienia enzymatycznego) oddzielny wpis, jako że jest to bardzo obszerny temat, który dotyczy nie tylko owoców, ale też m.in. krewetek.
Oczywiście udzielę rady, jak można zapobiegać ciemnieniu owoców. Przede wszystkim należy zatrzymać, bądź spowolnić reakcje enzymatyczne. Można zapobiec tym procesom (utleniania) poprzez zastosowanie antyoksydantów, np. witaminy E lub C, która znajduje się właśnie w soku z cytryny. Innym sposobem zatrzymania tego procesu jest obróbka cieplna, która deaktywuje, czyli zabija enzymy.
Pingback: Tłuszcze - Nauka na talerzu - Marta Szumiata
Pingback: Idealne jajko na miękko - Nauka na talerzu - Naukowo o gotowaniu i jedzeniu
Pingback: Karmelizacja - Nauka na talerzu - Naukowo o gotowaniu i jedzeniu
Pingback: Reakcje Maillarda - Nauka na talerzu - Naukowo o gotowaniu i jedzeniu
Pingback: Idealny karmel - Nauka na talerzu - Marta Szumiata
Pingback: Idealne jajko poszetowe - Nauka na talerzu - Marta Szumiata
Pingback: Sous-vide - Nauka na talerzu - Naukowo o gotowaniu i jedzeniu
Pingback: Idealny bulion - rosół - Nauka na talerzu - Marta Szumiata
Pingback: Idealny stek - Nauka na talerzu - Marta Szumiata
Pingback: Blanszowanie - Nauka na talerzu - Marta Szumiata
Pingback: Czy idealny stek musi odpoczywać po smażeniu? - Nauka na talerzu - Marta Szumiata
Pingback: Gluten - Nauka na talerzu - Marta Szumiata - gluten
Pingback: Idealne naleśniki - Nauka na talerzu - Marta Szumiata
Pingback: Idealny piernik - Nauka na talerzu - Marta Szumiata
Pingback: Idealne ciasto z cukinii - Nauka na talerzu - Marta Szumiata
Pingback: Gotowanie na wolnym ogniu - Nauka na talerzu - Marta Szumiata
Pingback: Idealne puree z dyni - Nauka na talerzu - Marta Szumiata
Pingback: Prażenie orzechów - Nauka na talerzu - Marta Szumiata
Pingback: Chleb: składniki - Nauka na talerzu - Marta Szumiata
Pingback: Idealne amerykańskie pancakes - Nauka na talerzu - Marta Szumiata
Pingback: Katsuobushi - Nauka na talerzu - Marta Szumiata
Pingback: Smażenie w głębokim tłuszczu - Nauka na talerzu - Marta Szumiata
Pingback: Jak przechowywać chleb, by nie był czerstwy? - Nauka na talerzu
Pingback: Idealny lukier - Nauka na talerzu - Marta Szumiata
Pingback: Jak gotować jajka? - Wywiad z Tomkiem Zielke - Najlepsza jajecznica
Pingback: Mleko - Nauka na talerzu - Marta Szumiata
Pingback: Idealne ciasto drożdżowe - Nauka na talerzu - Marta Szumiata
Pingback: Idealne frytki - Nauka na talerzu - Marta Szumiata
Pingback: Po co dodawać mleko do herbaty? - Nauka na talerzu - Marta Szumiata
Pingback: Idealny ganache czekoladowy - Nauka na talerzu - Marta Szumiata
Pingback: Idealna kruszonka - Nauka na talerzu - Marta Szumiata
Pingback: Idealny sernik - Nauka na talerzu - Marta Szumiata
Pingback: Palone masło - Nauka na talerzu - Marta Szumiata
Pingback: Idealna jajecznica - Nauka na talerzu - Marta Szumiata
Pingback: Masło klarowane - Nauka na talerzu - Marta Szumiata
Pingback: Ciasto dyniowe 'pumpkin pie' Nowy smak - Nauka na talerzu - Marta Szumiata
Pingback: Lody miodowe - Nauka na talerzu - Marta Szumiata
Pingback: Jak zrobić drożdżowe? - Wywiad z Moniką Walecką - Cała w Mące
Pingback: Lody - składniki - Nauka na talerzu - Marta Szumiata
Pingback: Masło orzechowe - Nauka na talerzu - Marta Szumiata
Pingback: Custard - Nauka na talerzu - Marta Szumiata
Pingback: Masa makowa - Nauka na talerzu - Marta Szumiata
Pingback: Karmelowy ser - Nauka na talerzu - Marta Szumiata
Pingback: Jak powstaje Czekolada - Nauka na talerzu - Marta Szumiata
Pingback: Chleb: przygotowanie - Nauka na talerzu - Marta Szumiata